湾豆说:2021年9月1日,尹延东博士(现深圳湾实验室特聘研究员)与合作者在Molecular Cell上发表题为“A Basal-Level Activity of ATR Links Replication Fork Surveillance and Stress Response”的研究长文。该研究通过单分子定位成像技术以及基于高阶相关函数的图像挖掘技术,半定量阐释了细胞内ATR及相关因子活性与单个复制叉上RPA负载量的关联等,提出了基于扩散的ATR-RPA随机碰撞理论以及基于此理论的复制进程监控 (Replication Surveillance) 与阻滞响应 (Stress Response) 的物理关联,为以ATR为核心的复制应激响应的分子机制研究提供新的见解。
DNA复制是生命活动基础核心过程之一,复制叉是其基本功能单元。就人类细胞而言,复制叉主要包括母代DNA解旋酶系统 (MCM),子代DNA合成酶系统 (PCNA-Polε/δ),以及已解旋但尚未被复制的单链DNA-RPA部分 (ssDNA-RPA) 等。在复制过程中,多个复制叉高度协调,保证在较短时间内快速完成全基因组复制。
然而,在DNA复制过程中,细胞往往会遭遇来自内源 (和外源) 的复制阻滞 (Replication Stress, RS) ,潜在影响DNA复制的高效性准确性以及由错误复制而导致的基因组损伤。为了减小RS的影响并维持基因组稳定性,细胞会在RS发生时启动一系列的信号网路来调整在胁迫环境中DNA复制的进程。作为这一系列信号网路的首要核心单元,ATR承担了对RS的识别以及激活下游多种信号通路的重要功能。
在先前的研究中,研究人员发现在胁迫环境中复制叉会因复制阻滞而积累大量RPA,而ATR正是通过识别RPA的富集来识别RS并启动后续响应机制。然而,ATR如何“观察/感知/测量”单个复制叉上RPA的数量这一基本问题尚未得到解释。
2021年9月1日,尹延东博士(现深圳湾实验室特聘研究员)与合作者在Molecular Cell上发表题为“A Basal-Level Activity of ATR Links Replication Fork Surveillance and Stress Response”的研究长文。该研究通过单分子定位成像技术以及基于高阶相关函数的图像挖掘技术,半定量阐释了细胞内ATR及相关因子活性与单个复制叉上RPA负载量的关联等,提出了基于扩散的ATR-RPA随机碰撞理论以及基于此理论的复制进程监控 (Replication Surveillance) 与阻滞响应 (Stress Response) 的物理关联,为以ATR为核心的复制应激响应的分子机制研究提供新的见解。

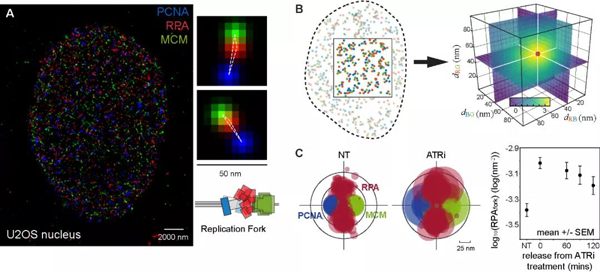
超分辨显微成像技术得以将细胞内大分子复合物的组成构造看的”更清楚” (图1A),但针对诸如细胞核内相对无序拥挤的复杂环境,仍需结合数理统计的方法对看似混乱的复杂超分辨图像进行深度挖掘,通过提取有效定量信息将图像看的”更明白”。在该项研究中,研究人员利用其先前开发的基于三阶相关函数的图像挖掘技术 (图1B,Nature Communications 2019),分析了细胞核内单个复制叉上RPA的平均承载量。
分析表明,在正常复制的细胞中,抑制ATR的活性 (ATRi) 会导致平均每个复制叉上的RPA载量增加,而恢复ATR活性会在一定程度上还原单个复制叉的RPA载量 (图1C),暗示了在无外源RS的情况下,ATR即与复制叉存在相互作用,调节控制复制叉的RPA载量。值得一提的是,在正常复制情况下ATR调控单个复制叉RPA载量是该研究首次确认的ATR的另一活性,与先前普遍接受的ATR负向调控复制起始这一活性相对独立,没有直接相关。
为了进一步研究ATR对单个复制叉RPA载量的调控机制,研究人员检查了RPA2结构域上第33位丝氨酸 (RPA2-S33) 的磷酸化状态对RPA载量的影响。RPA2-Ser33是已知ATR对RPA磷酸化的首要靶点。研究表明,当Ser33被突变成Ala33 (S33A) 以防止磷酸化带来的电荷变化时,单个复制叉上RPA载量有所上升;而当其被突变成Asp33 (S33D) 以模拟磷酸化时,并不显著影响RPA载量,暗示了ATR对RPA2-S33磷酸化是ATR负向调控RPA载量的必要但非充分因素。
另一方面,研究人员利用体外单分子荧光共振能量传递技术 (smFRET) 检查了上述两种突变对RPA与单链DNA结合效率的影响。研究表明S33D突变会导致RPA2结构域与单链DNA结合松动,但未观察到该单点突变对整体RPA-ssDNA结合效率的显著影响,进一步暗示ATR对RPA2-S33的磷酸化有助于RPA从单链DNA脱落但并非RPA完全解离的充分因素。
最后,研究人员进一步分析了在外源RS存在环境下单个复制叉上RPA和ATR的载量。研究表明,在RS引发的RPA载量升高的同时,ATR载量伴随升高,暗示了ATR和RPA之间扩散驱动的随机碰撞反应模式的可能性。基于此,研究人员通过对RS引发的RPA累积、自由扩散的ATR与RPA的随机碰撞、以及ATR协助RPA解离等过程数值模拟,再现了上述实验事实,并以此提出了ATR-RPA随机碰撞的分子通讯机制 (图2):在复制叉正常行进时,ATR因自由扩散与RPA发生随机碰撞,是ATR与RPA之间通讯的物理基础;当复制叉在行进中遇到复制阻滞时,RPA-ssDNA在复制叉处积累,ATR-RPA的碰撞截面增大,从而伴随ATR在受阻复制叉处的富集;富集的ATR有更高的概率与复制叉处的ATR激活因子碰撞实现ATR信号通路的激活,同时ATR的富集也为ATR之间的自磷酸化 (Auto-phosphorylation) 提供浓度基础,实现ATR信号的放大。
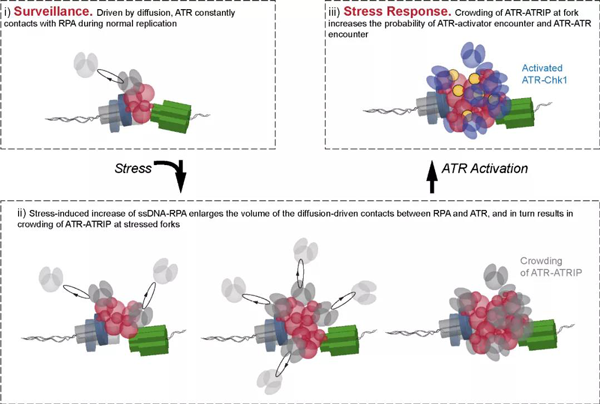
该项研究阐释了ATR进行复制监控与其受激响应之间的基本物理关联,为以ATR抑制剂为核心的小分子抗癌药物的开发提供新的思路。

尹延东
特聘研究员
尹延东博士今年5月起全职加入深圳湾实验室,他2008年本科毕业于北京大学化学与分子工程学院;2013年在北京大学化学与分子工程学院获得博士学位;2014年起在纽约大学医学院(New York University School of Medicine)从事博士后研究工作,先后担任博士后研究员(Postdoc Fellow)和助理研究员(Research Scientist)。尹延东博士先前的科研方向包括单分子荧光相关光谱技术的开发,高内涵复杂超分辨图像高阶相关技术的开发,以及双螺旋DNA分子碱基翻转动力学、DNA受抑复制及应激响应的生物物理机制的研究。迄今以第一作者、共同第一作者、或通讯作者在Nature Communications, Molecular Cell, PNAS, Journal of Physical Chemistry Letter等杂志上发表多篇研究论文。
尹延东课题组的主要科研兴趣和方向包括:
1) 新型体外单分子动力学实验技术的创新开发;
2) 新一代快速超分辨光学显微成像技术的创新开发。包括但不限于:基于单分子定位的快速超分辨成像技术、基于结构照明的快速超分辨成像技术等;
3) 新型复杂图像重构及定量解析的技术创新快发。
围绕上述基于单分子动力学、快速超分辨显微成像、及活体细胞成像等技术,尹延东课题组将着力于阐释人体癌细胞中DNA复制、表观遗传印记复制、DNA损伤及修复的分子动力学本质;着眼于开发针对癌症、肿瘤的新一代(表观)基因疗法。
论文原文:
A Basal-Level Activity of ATR Links Replication Fork Surveillance and Stress Response
文章来源 | 小柯生命



