本期为大家介绍一篇发表于ACS Chem. Biol. 的文章,题目是“Small Molecule-Activated O-GlcNAcase for Spatiotemporal Removal of O-GlcNAc in Live Cells”。本文的通讯作者是哈佛大学的Christina M. Woo教授和深圳湾实验室的Yun Ge研究员。O连接的N-乙酰葡萄糖胺 (O-linked N-acetylglucosamine, O-GlcNAc) 是一种普遍存在的单糖翻译后修饰。该修饰由一对酶调控,即O-GlcNAc转移酶 (O-GlcNAc transferase, OGT) 和O-GlcNAc水解酶(O-GlcNAcase, OGA) (图1A)。O-GlcNAc修饰的异常与许多疾病有关,例如许多O-GlcNAc修饰的蛋白与肿瘤相关。因此,开发时空分辨的O-GlcNAc调控方法以研究其动态特征和生物学功能具有重要意义。
在本篇文章的工作中,作者设计了一种可控激活OGA的方法,以浓度依赖和时空分辨的方式调控O-GlcNAc (图1B)。作者将一段能被4-羟基他莫昔芬 (4-hydroxytamoxifen, 4-HT)触发剪接的内含肽插入OGA中,将其变成无活性的OGA-内含肽融合蛋白。使用4-HT处理改造的OGA后,该内含肽能自我剪接,从而使OGA能够重新折叠并恢复去糖基化活性。作者通过将OGA-内含肽锚定在不同的亚细胞区域,成功地在特定区室中进行了O-GlcNAc的去糖基化。此外,作者还利用4-HT拮抗雌激素受体和激活OGA-内含肽的双重能力实现了对MCF-7细胞的生长抑制。
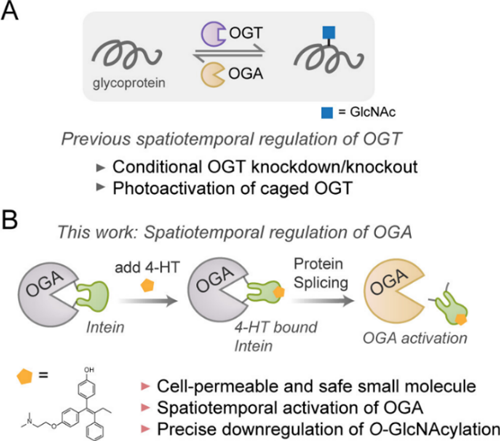
图1.4-HT激活改造后的OGA实现活细胞中O-GlcNAc水平的时空下调
首先,作者对OGA进行了工程化改造。他们使用一种尺寸更小、结构更简单且仍具相当催化活性的miniOGA变体作为插入内含肽的初始模板。由于内含肽剪接会留下单个半胱氨酸残基,为了尽量减少OGA蛋白序列的改变,他们选择了不同结构域的半胱氨酸残基作为候选,筛选插入内含肽后使OGA失去活性的位点 (图2A)。作者总共构建了9个位点的OGA-内含肽变体,随后将这些OGA-内含肽变体与模型糖蛋白Nup62一起在HEK293T细胞中瞬时表达,在加入小分子4-HT后,通过免疫印迹检测OGA-内含肽的剪接,并通过检测Nup62上的O-GlcNAc修饰水平来评估其酶活性。他们发现,OGA-内含肽(C181)变体在没有4-HT的情况下几乎没有活性,但在4-HT存在下产生剪接产物miniOGA并表现出较高的去糖基化活性(图2B,C)。除C181位点的变体外,其他变体在4-HT触发下产生很少的剪接产物或几乎不发生剪接。因此随后作者使用OGA-内含肽(C181)变体来进行小分子触发的去糖基化实验。
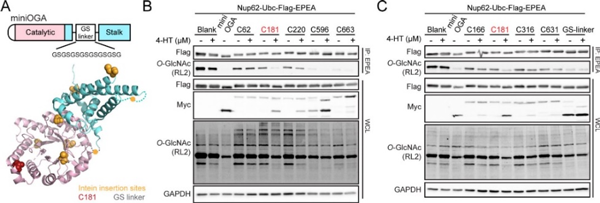
图2. 筛选miniOGA的内含肽插入位点并测试OGA-内含肽的激活
接下来,作者表征了不同条件下的激活效果。他们在1nM至5μM的浓度范围内测试了4-HT触发的OGA激活和Nup62上糖基化水平变化。随着4-HT剂量的升高,他们观察到OGA-内含肽的剪接逐渐增加,且Nup62上O-GlcNAc修饰逐渐降低(图3A)。随后,作者评估了4-HT激活OGA-内含肽的时间依赖性。他们首先在体外测定4-HT处理后OGA的活性,发现糖苷酶活性随着4-HT孵育时间的增加而升高 (图3B)。作者还研究了内源O-GlcNAc稳态调控机制对4-HT扰动O-GlcNAc水平的响应。他们使用1μM 4-HT进行了时间梯度激活实验,观察到剪接产物随孵育时间增加而逐渐积累,且3小时后Nup62糖基化修饰显著下调。同时,内源OGT蛋白水平也表现出明显的代偿性增加 (图3C)。这些结果表明,4-HT触发OGA-内含肽的激活是剂量和时间依赖的,同时该过程会诱导调节反馈以维持细胞O-GlcNAc的稳态。
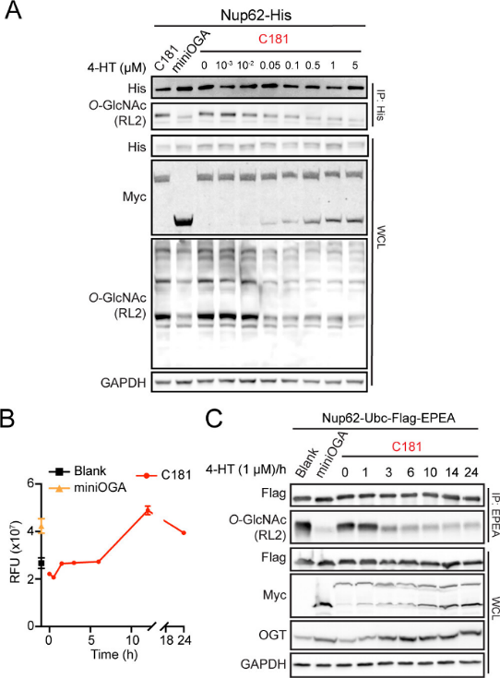
图3. 4-HT对OGA-内含肽的剂量和时间依赖性激活
O-GlcNAc修饰能够响应环境的变化并且在细胞中具有独特的空间特异性动力学。因此,作者希望利用4-HT触发OGA-内含肽激活的策略来实现空间特异的去糖基化。他们首先研究了在有无4-HT处理下的OGA-内含肽(C181)的细胞内分布。OGA-内含肽(C181)在活化前主要位于细胞质中,活化后部分转运到细胞核,与miniOGA的分布一致。随后,作者在OGA-内含肽(C181)上附加了核定位序列 (NLS) 与核输出序列 (NES)。激活前两种变体均主要表现出胞质分布。在4-HT激活后,剪接后的OGA-内含肽(C181)-NLS(C181-NLS)部分易位到细胞核中,而OGA-内含肽(C181)-NES(C181-NES)保留在细胞质中 (图4A)。
接下来,作者研究了这些融合变体是否能实现空间选择性去糖基化。他们在HEK293T细胞中将Nup62与三种变体C181-WT,C181-NLS和C181-NES共表达,并测量Nup62的O-GlcNAc水平。在使用4-HT后,只有C181-WT和C181-NES降低了Nup62的O-GlcNAc水平 (图4B)。随后,他们利用NLS将Nup62定位到细胞核,并使用三种变体进行了类似的共表达和4-HT激活实验,发现仅C181-WT和C181-NLS能发生4-HT触发的去糖基化 (图4C)。
为了进一步验证这些亚细胞定位的OGA-内含肽变体介导的去糖基化,他们在用4-HT处理表达C181-NLS的细胞24小时后,富集O-GlcNAc修饰蛋白组并做质谱鉴定。结果表明,4-HT孵育可以特异性降低核蛋白上的O-GlcNAc水平 (图4D)。GO分析也显示显著去糖基化的蛋白质主要存在于细胞核和核相关复合物中 (图4E)。这些结果表明,将OGA-内含肽(C181)定位到特定的亚细胞区室能够实现空间选择性去糖基化,并且不会干扰其他亚细胞位置的糖蛋白,从而实现细胞内O-GlcNAc的空间控制。
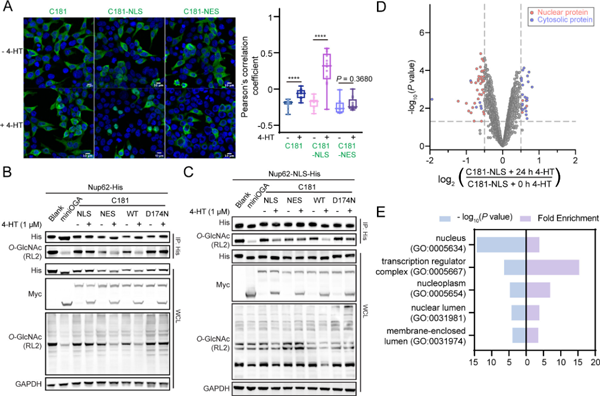
图4. HEK293T细胞中OGA-内含肽经4-HT激活后在特定区域诱导O-GlcNAc去糖基化
除了激活内含肽剪接外,4-HT也是乳腺癌药物他莫昔芬 (tamoxifen) 的活性代谢物。乳腺癌细胞中OGT水平升高和OGA水平降低导致其蛋白质组中O-GlcNAc水平升高。他莫昔芬和4-HT均能抑制ER阳性乳腺癌来源的MCF-7细胞增殖,但长期使用会出现耐药性。先前研究表明,O-GlcNAc水平上升可保护MCF-7细胞免受他莫昔芬诱导的细胞死亡。因此作者推测O-GlcNAc的减少能够增加MCF-7细胞对4-HT的敏感性,并假设4-HT对乳腺癌细胞增殖的抑制和对OGA-内含肽的活化可协同加速细胞死亡 (图5A)。他们在MCF-7细胞系中分别稳定表达活性OGA-内含肽(C181)及其无活性突变体(D174N)。结果发现,只有在用4-HT处理MCF7-C181时,才能观察到O-GlcNAc水平的降低,并且5μM 的4-HT就能显著抑制细胞增殖,而抑制野生型MCF-7和MCF7-C181_D174N则需要更高浓度的4-HT,这表明去糖基化使得MCF-7对4-HT较为敏感 (图5B),这些结果可能有助于解决耐药性等问题。
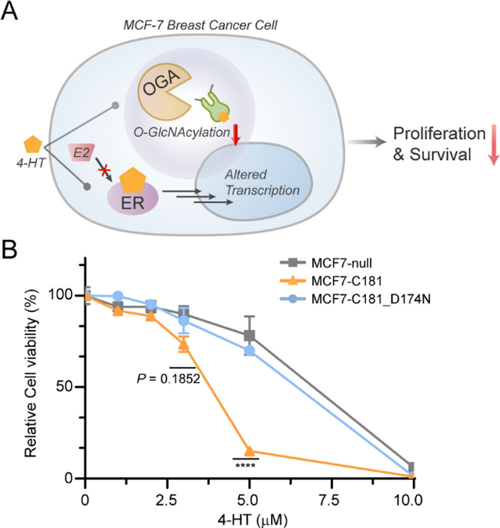
图5. 4-HT激活OGA-内含肽导致MCF-7细胞活力抑制
总结来说,作者在活细胞中开发了一种小分子激活OGA的策略,用于O-GlcNAc的时空去除。作者首先筛选了一组响应4-HT剪接的内含肽的插入位点,并获得了最佳的OGA-内含肽(C181)变体。OGA-内含肽(C181)的激活和O-GlcNAc的去除是剂量和时间依赖的。此外,将OGA-内含肽(C181)定位到不同的亚细胞位置成功实现了对去糖基化的空间控制。最后,作者证明了4-HT通过拮抗雌激素受体和激活OGA-内含肽(C181)加速了细胞死亡,这说明调节O-GlcNAc可能导致癌细胞对药物处理更加敏感,从而达到理想的治疗结果。
原文信息:Small Molecule-Activated O-GlcNAcase for Spatiotemporal Removal of O-GlcNAc in Live Cells




